
16 jun 2014
Biodisponibilidade de Fármaco
O conceito de biodisponibilidade é definido como a velocidade e extensão da absorção do fármaco a partir de uma determinada forma farmacêutica, tornando-se disponível no local de ação. Quando fármacos de ação sistêmica são administrados por via extra vasculares, a absorção passa a ser um pré-requisito para o efeito terapêutico dos mesmos e a biodisponibilidade passa a ser associada diretamente à qualidade do medicamento (SHARGEL, YO, 2005).
A definição sugerida pela FDA é a mais utilizada mundialmente e refere-se à quantidade absorvida de um fármaco, a partir de sua forma farmacêutica, e a velocidade pela qual esse processo ocorre. De acordo com essa definição verifica-se que a biodisponibilidade é uma propriedade que deriva da administração do medicamento ao organismo e que pode citar a forma farmacêutica, deixa claro que a mesma pode influencia-la (BUENO, 2005).
A definição observada no "Note for Guidance on the Investigation of Bioavailability" do "Committee for Proprietary Medicinal Products" (CPMP), da agência europeia de avaliação de medicamentos (EMEA), é a mais abrangente: biodisponibilidade é a extensão e a velocidade com a qual substância ou seu componente ativo é liberado a partir de uma forma farmacêutica na circulação sistêmica (EMEA, 2001).
É um parâmetro relacionado ao processo de absorção do fármaco a biodisponibilidade. Tal parâmetro tem grande importância para medicamentos que são administrados por uma via em que ocorra o processo de absorção (oral, intramuscular, subcutânea, transdérmica, retal, vaginal...), ou seja, uma via extra vascular (ABDOU, 1989).
A absorção é a transferência do fármaco do local de administração para a corrente sanguínea. Assim, por definição, um medicamento administrado por via intravascular é 100% biodisponível, isto é, toda dose do fármaco administrada diretamente na corrente sanguínea e está disponível para interagir com os receptores e desencadear o efeito farmacológico (ASHFORD, 2005a).
Com exceção da via intravenosa, todas as demais vias de administração para as quais seja requerida uma ação sistêmica implicam na absorção do fármaco para a corrente sanguínea a partir da via de administração (ASHFORD, 2005a).
Utilizam os dados da biodisponibilidade para avaliar a bioequivalência do fármaco, onde pode ser observada a quantidade do medicamento absorvido e a permanência do medicamento no organismo (SPINOSA, GÒNIAK, BERNARDI, 1996).
A relação entre o fármaco, à forma farmacêutica que o contém e a via pela qual é administrado determina quanto e com que velocidade esse fármaco entra na circulação sistêmica. Para que um fármaco seja eficaz é necessário que uma quantidade suficiente dele chegue ao sítio ou sítios de ação e ali permaneçam pelo tempo suficiente para exercer o efeito farmacológico (ASHFORD, 2005a).
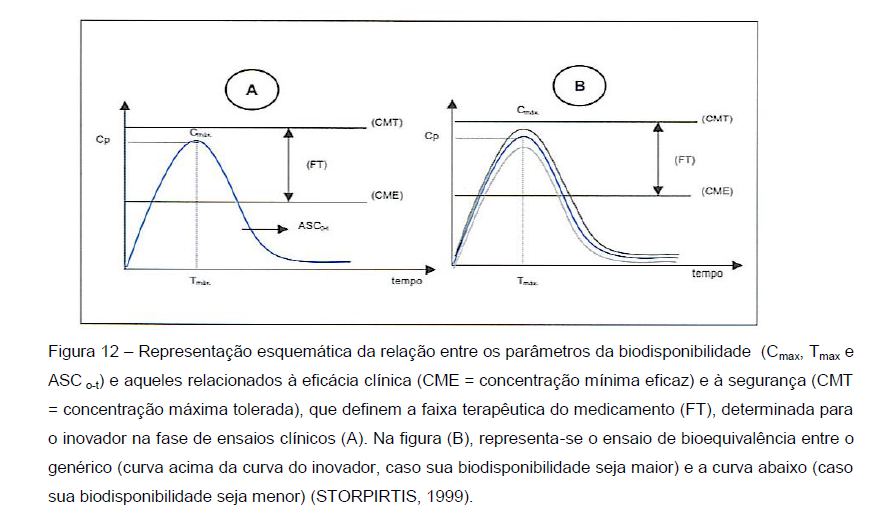
Diferenças em relação às características físico química do fármaco e demais componentes da formulação, bem como processo de fabricação distinto, podem gerar diferenças de biodisponibilidade que, no caso de medicamentos genéricos, podem comprometer a bioequivalência e intercambialidade. Tal fato pode ser evitado realizando-se o desenvolvimento farmacotécnico do produto de maneira adequada (KU, 2008).
O medicamento inovador, durante seu desenvolvimento, passa por testes que avaliam sua biodisponibilidade e a relação entre essa propriedade e a eficácia e segurança do produto (STORPIRTIS, 1999).
Os estudos de biodisponibilidade de medicamentos são empregados com várias finalidades. Dentre elas, destacam- se: (i) avaliação da bioequivalência de medicamentos; (ii) avaliação de medicamentos que contem fármacos novos na terapêutica; (iii) avaliação de novas formulações contendo fármacos já conhecidos; (iv) avaliação de formas farmacêuticas de liberação modificada; (v) avaliação de medicamentos com vários fármacos; (vi) avaliação de alterações na formulação de um medicamento; (vii) avaliação de alteração de posologia/ esquema terapêutico (STORPIRTIS, CONSIGLIERI, 1995).
As variações de perfis de biodisponibilidade de medicamentos ocorrem, principalmente, em função das diferenças observadas em relação à eficiência e velocidade de absorção de fármacos. Os fatores fisiológicos inerentes a cada indivíduo e os fatores relacionados à forma de dosagem utilizada são os principais responsáveis por essas alterações. Por esse motivo, formas farmacêuticas sólidas, administrada por via oral, apresentam frequentemente problemas de biodisponibilidade em relação a outras formas de dosagem (STEPPE, 1995).
Fabricação de produtos farmoquímicos e os respectivos roteiros de inspeção, estes últimos criados para serem utilizados pelas autoridades sanitárias dos países membros para a verificação das conformidades das boas práticas de fabricação nas indústrias farmacêuticas e farmoquímicas. O surgimento do tratado MECOSUL foi um passo importante para a otimização do processo de monitoramento da qualidade da produção de medicamentos (ROZENFELD, 2000).
Diferenças na biodisponibilidade de formulações orais foram reconhecidas no início da década de sessenta. Tais observações levaram à fundamentação dos primeiros critérios para o estabelecimento de teste de bioequivalência pela FDA em 1977 (KORTEJAVI, URTTI, YLIPERTTULA, 2007).
O tamanho da partícula, a velocidade de dissolução, área de superfície, polimorfismo do fármaco, formação de sais, permeabilidade lipofílica, pKa interferem na biodisponibilidade do fármaco. A solubilidade pode ser melhorada com o processo de micronização (FANGUEIRO et al 2012).
Deve ressaltar que o pKa acima de 10 ou abaixo de 3 não possui uma boa absorção quando administrado por via oral, a absorção acontece por uma relação entre o pKa e o pH que ocorre no trato gastro intestinal (SPINOSA, GÒNIAK, BERNARDI, 1996).
A solubilidade é determinante para a liberação e absorção onde é extremamente importante na biodisponibilidade. Se a base é fraca e o pH baixo ou o acido fraco e o pH alto a dissolução é mais rápida (BONAMICI, 2009).
A velocidade de dissolução está associada à granulometria do pó. O tamanho da partícula interfere na velocidade de dissolução e absorção, quanto menor a partícula for maior a superfície de contato oque irá melhor e acelerar a absorção. A forma farmacêutica influencia na absorção e interfere diretamente na biodisponibilidade, a suspensão geralmente é utilizada para fármacos insolúveis ou poucos solúveis. A absorção é a transferência do fármaco do local de administração para a corrente sanguínea. Para que a absorção do fármaco ocorra, o fármaco deve atravessar a membrana das células da parede intestinal (BONAMICI, 2009), o local de maior absorção é o intestino delgado (SPINOSA, GÒNIAK, BERNARDI, 1996).
Após a absorção o medicamento pó na forma livre no sangue pode-se ligar a proteínas plasmáticas ou ser sequestrada para depósitos no organismo. A meia vida é o tempo para que a concentração do fármaco no sangue caia para metade (SPINOSA, GÒNIAK, BERNARDI, 1996).
Etapas que ocorrem durante a absorção:
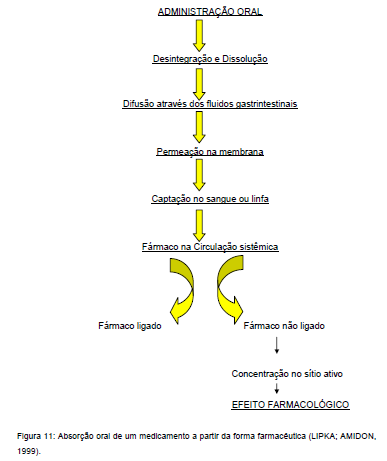
Todos esses passos podem ter relação direta com a mucosa intestinal, esvaziamento gástrico e trânsito gastro intestinal, os quais tem impacto significante na velocidade e extensão da absorção do fármaco e, portanto na eficácia e segurança do medicamento (LIPKA, AMIDON, 1999).
O avanço das pesquisas científicas nas últimas décadas tem evidenciado que a segurança e a eficácia clínica dos medicamentos não podem ser atribuídas exclusivamente às propriedades farmacológicas intrínsecas do fármaco. Fatores ligados às suas propriedades físicas químicas, bem como aqueles relacionados aos excipientes empregados na formulação, além do processo de fabricação, têm sido considerados responsáveis por alterações no efeito dos medicamentos, uma vez que pode afetar a biodisponibilidade dos fármacos. A influência de excipientes comuns não era estudada no passado, no entanto, verificou-se a presença de determinados excipientes pode alterar a velocidade e extensão de absorção de fármacos (CHEN et al, 2007; PANCHAGNULA, THOMAS, 2000).
Muitos fármacos que são submetidos aos processos de investigação falham durante o desenvolvimento pré-clínico e clínico, sendo que 46% dos compostos que passam para a fase de desenvolvimento clínico são rejeitados devido aos problemas de eficácia e 40% por problemas de segurança (VARMA et al, 2004).
A bioequivalência consiste na demonstração de equivalência farmacêutica entre produtos apresentados sob a mesma forma farmacêutica, contendo idêntica composição qualitativa e quantitativa de princípio (s) ativo (s) e que tenham comparável biodisponibilidade quando estudados sob um mesmo desempenho experimental (ANVISA, 1999b).
O sistema de classificação biofarmacêutica pela disposição, ou eliminação de fármacos poderá ser classificado como sendo de alta permeabilidade se a sua principal via de eliminação for através do metabolismo. Caso a principal via de eliminação for através da excreção renal ou biliar, ou mesmo se o fármaco for excretado inalterado, então a classificação será de baixa permeabilidade (WU, BENET, 2005).
Conclusão:
Diante a revisão proposta pode se concluir que biodisponibilidade é a taxa e a extensão (quantidade) na qual uma molécula ativa (fármaco) é absorvida e fica disponível no sítio de ação da droga (FITTIPALDI, PEDRAZZOLI JUNIOR, 2002; PEREIRA, AGUIAR, 2011).
Referências:
ABDOU, H,M.; Dissolution, bioavalilability & bioequivalence. Easton: Mack Publishing, 1989. 554p.
Agência nacional de vigilância snitária. Legislação. VisaLegis. Lei n. 9787, de 10 de fevereiro de 1999b. Altera a Lei n. 6.360, de 23 de setembro de 1976, que dispõe sobre a vigilância sanitária, estabelece o medicamento genérico, dispõe sobre a utilização de nomes genéricos em produtos farmacêuticos e da outras providencias.
ASHFORD, M. Introdução á biofarmácia. In: AULTON, M.E. Delineamento de formas farmacêuticas. 2.ed, Porto Alegre: Artemed, 2005a. cap.15, p.225- 228.
BONAMICI, DENISE. Sistema de classificação biofarmacêutica e bioisenções. Dissertação para mestre. Universidade de São Paulo. São Paulo, 2009.
BUENO, M.M. Implantação, evolução, aspectos técnicos e perspectivas da regulamentação técnica de biodisponibilidade relativa e bioequivalencia de medicamentos genéricos e similares no Brasil. São Paulo, 2005. 1993.p, Dissertação de mestrado - Faculdade de Ciências Farmacêuticas, Universidade de São Paulo.
CHEN, M.L.; STRAUGHN, A.B.; SADRIEH, N.; MEYER, M.; FAUTINO, P.J.; CIAVARELLA, A.B.; MEIBOHN, B.; YATES, C.R.; HUSSAIN, A.S. A modern view of excipient effecs on bioequivalence: case study Sorbitol. Pharmaceutical Research, v.24, n.1, 73-80, 2007.
FANGUEIRO, J.F., MARQUES, I.R., SEVERINO, P., SANTANA, M.H.A., SOUTO, E. B. DESENVOLVIMENTO, PRODUÇÃO E CARACTERIZAÇÃO DE NANOCRISTAIS DE FÁRMACOS POUCO SOLÚVEIS. Quim. Nova, Vol. 35, No. 9, 1848-1853, 2012.
FITTIPALDI, J.A.S., PEDRAZZOLI JUNIOR, J. Manual de boas práticas em biodisponibilidade: bioequivalência /Agência Nacional de Vigilância Sanitária. Gerência-Geral de Inspeção e Controle de Medicamentos e Produtos. BrasÌlia: ANVISA, 2002.
KORTERJAVI, H.; URTTI, M.; YLIPERTTULA, M. Pharmacokinetic simulation of biowarver criteria: the effects of gastric emptying, dissolution, absorption and elimination rates. European jornal of pharmaceutical sciences, v.30, p.155- 166, 2007.
KU, M.S. Use of biopharmaceutical classification systenm in early drug development. AAPS Journal, v.10, n.1, p. 208- 212, 2008.
LIPKA, E.; AMIDON, G.L.; Setting bioequivalence requirementes for drug development based on preclinical data: optimizing oral drug delivery systens. Jornal of controled release, v.62, p.41-49, 1999.
PANCHAGNULA, R.; THOMAS, N.S. Biopharmaceutics and pharmacokinetics in drug research. International journal of pharmaceutics, v.201, p.131- 150, 2000.
PEREIRA, R., AGUIAR, M.M.G. Biodisponibilidade e bioequivalência de medicamentos. Anais, II Simpósio do curso de farmácia, centro universitário Newton Paiva. Tecnologia Farmacêutica e cosmética. p-27 á 29, 2011.
ROZELFELD, S. Fundamentos da vigilância sanitária. São Paulo. FIOCRUZ, 2000. 299p.
SHARGEL, L.; YU, A.B.C.; PONG, S.W.; Applied biopharmaceutics & pharmacokinetics. 5.ed, New York. Appleton & Lange Reviews, MacGraw- Hill, 2005. 892p.
SPINOSA, H.S., GÒRNIAK, S.L., BERNARDI, M.M. Farmacologia aplicada à medicina veterinária. Guanabara Koogan. Rio de Janeiro, 1996.
STEPPE, M. Avaliação da biodisponibilidade e bioequivalência de suspensões extemporâneas de amoxiciclina. Porto Alegre, 1996. 183.p [Dissertação de mestrado, Faculdade de ciências farmacêutica da Universidade federal do Rio Grande do Sul]
STTORPORTIS, S. Biofarmacotécnica: fundamentos da biodisponibilidade, bioequivalência, dissoluçãoe intercambialidade de medicamentos genéricos. São Paulo, 1999. 78.p [apostila].
STTORPORTIS, S.; CONSIGLIERI, V.O. Biodisponibilidade e bioequivalência de medicamentos: aspectos fundamentais para o planejamento e execução de estudos. Revista de farmácia e bioquímica da universidade de São Paulo. v.31, n.2, p.63-70, 1995.
VARMA, M.V.S.; KHANDAVILLI, S,; ASHOKRAJ, Y.; JAIN, A.; DHANIKULA, A.; SOOD, A.; THOMAS, N.S.; PILLAI, O.; SHARMA, P.; GANDHI, R.; AGRAWAL, S.; NAIR, V.; PANCHAGNULA, R. Biopharmaceutic classification system: a scientific framework for pharmacokinectic optimization in drug research. Current Drug Metabolism, v.5, n.5, p. 375-378, 2004.
WU, C.Y.; BENET, L.Z. Predicting drug disposition via application of BCS: Tansport/ absorption/ elimination interplay and development of a biopharmaceutical drug disposition classification system. Pharmaceutical research, v. 22, n.1, p.11- 23, 2005.
YU, L.X.; AMIDON, G.L.; POLLI, J.E.; ZHAO, H.; MEHTA, M.U.; CONNER, D.P.; SHAH, V.P.; LESKO, L.J.; CHEM, M.L.; LEE, V.H.L.; HUSSAIN, A.S.; Biopharmaceutics classification system: the scientific basis for biowaiver extensions. Pharmaceutical Research, v. 19, n.7, p. 921- 925, 2002.
Ana Carolina Izidoro de Moraes, Lucas Belarmino da Silva e Luciano Catelli
Departamento Aves e Suínos